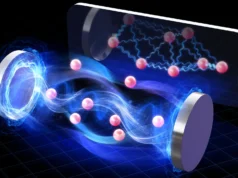
Los agregados de beta amiloide (A-beta) son ovillos de proteínas que están particularmente asociados con enfermedades neurodegenerativas como el Alzheimer. Sin embargo, a pesar de su persistencia en la luz, los investigadores no han podido comprender completamente cómo se ensambla y descompone A-beta.
“La forma en que A-beta se comporta en una variedad de entornos, incluido el cerebro humano”, dijo Brian Sonn, ex estudiante de ingeniería y sistemas eléctricos en la Universidad de Washington en St. Louis, que ahora es estudiante de doctorado en la escuela. de
“Existe una comprensión del crecimiento y el declive que no ha desaparecido por completo”, añadió.
Eso está a punto de cambiar, gracias a una investigación publicada recientemente por Sun con colegas en el laboratorio del profesor asociado Matthew Liu en el Departamento de Ingeniería Eléctrica y de Sistemas (ESE) de Preston M. Green en la Escuela de Ingeniería McKelvey de Washio. .
En el primer trabajo de este tipo, Suraj y sus colegas pudieron medir los conjuntos de láminas beta de fibrillas de amiloide, la viga básica de la agregación de proteínas, a medida que cambiaban. Estudios anteriores de microscopía de alta resolución solo han obtenido tomas estáticas.
“Queríamos observar específicamente la dinámica de la estructura subyacente de A-beta que podría ser responsable de los cambios que estamos viendo, no sólo cambios en la conformación general”, dijo Sun.
Lew usa Lego como analogía, señalando que la tecnología de imágenes actual muestra un edificio de Lego completo pero no ve cómo está organizado cada ladrillo individual.
“Las proteínas individuales siempre están cambiando en respuesta a su entorno”, dijo Liu. “Es como si algunos ladrillos de Lego hicieran que otros cambiaran su forma. La arquitectura alterada de las proteínas y los agregados ensamblados contribuyen a la complejidad de las enfermedades neurodegenerativas”.
El laboratorio de Liu ha desarrollado un nuevo tipo de técnica de imágenes que les permite ver orientaciones y otros detalles minuciosos en las nanoestructuras de sistemas biológicos que antes eran invisibles. Su técnica, la microscopía de orientación y localización de una sola molécula (SMOLM), utiliza destellos de luz de una sonda química para visualizar las láminas de péptidos subyacentes al Aβ42, un tipo de péptido A-beta.
El uso de SMOLM les permitió observar las orientaciones individuales de las hojas beta centrales para ver la relación entre su organización y cómo se relaciona con la estructura general de la proteína amiloide.
Múltiples formas de reconstruir
Aβ42 está en constante cambio, y el primer paso es intentar encontrar un método para la locura, un modelo o modelo de acción para predecir el comportamiento de la proteína.
Ahora que el laboratorio de Liu pudo realizar estas mediciones, realizó algunas observaciones intuitivas y descubrió algunas sorpresas escondidas en la arquitectura de la beta amiloide.
Como era de esperar, las estructuras estables de Aβ42 tienden a retener láminas beta centrales estables. Las estructuras en crecimiento tienen láminas beta centrales que se vuelven más pronunciadas y rígidas a medida que continúa el crecimiento. Las estructuras corroídas exhiben láminas beta cada vez más desordenadas y menos rígidas. Pero también descubrieron múltiples formas en que Aβ42 puede repararse.
“Hay varias formas diferentes en que la estructura Aβ42 puede permanecer estable o crecer y decaer”, dijo Sun.
Los investigadores también descubrieron que Aβ42 puede crecer y degradarse de maneras que desafían las expectativas. Por ejemplo, Aβ42 puede crecer y degradarse de manera que se preserve la estructura básica. A veces el crecimiento ocurre donde los péptidos simplemente se apilan, pero la orientación básica de la hoja beta no cambia. En otros casos, Aβ42 sufre una “desintegración estable”, donde ocurre lo contrario, lo que significa que los péptidos se eliminan, pero la estructura de la hoja beta permanece. Finalmente, las láminas beta de Aβ42 a veces se reorganizan y cambian de orientación sin cambios inmediatos en la forma general. Esta reorganización nanoestructural puede crear el potencial para una remodelación a gran escala en el futuro.
“Debido a que SMOLM puede rastrear la organización subyacente de Aβ42 y no solo su conformación, podemos observar diferentes subtipos de remodelación que no se pueden ver con métodos de imágenes no orientacionales y limitados por difusión”, dijo Sun. dicho.
Si todo esto suena un poco confuso, tenga en cuenta que este es solo el primer vistazo a estas estructuras a nanoescala en constante cambio. No había ningún trabajo previo con el que comparar notas, lo que hace aún más notable que Sun haya producido el trabajo mientras hacía malabares con las restricciones de bloqueo de COVID-19 y su carga de estudios universitarios en WashU, que completó en tres años. Esto allana el camino para que él y otros puedan controlar realmente la arquitectura amiloide.
Probablemente abordará más de estas preguntas durante la fase de posgrado de su formación de médico y doctorado, donde planea diseñar sistemas de imágenes y sensores a nanoescala que revelen los mecanismos ocultos que pueden funcionar en enfermedades difíciles de tratar.
Sun le da crédito a la rigurosa capacitación brindada por el Departamento ESE de WashU y el Laboratorio Lew por hacer posible este estudio y trayectoria académica, así como al MSTP de WashU por continuar la investigación después de la graduación. “Estoy muy contento de haber recorrido este viaje”, dijo.
La investigación reportada en esta publicación fue apoyada por el Instituto Nacional de Ciencias Médicas Generales de los Institutos Nacionales de Salud bajo el Premio No. R35GM124858.