Los canales iónicos son poros diminutos que regulan el movimiento de partículas cargadas en los organismos vivos. Estas vías estrechas son esenciales para muchas funciones biológicas. En algunos casos, sus partes estrechas miden sólo unos pocos angstroms de ancho, aproximadamente el ancho de los átomos individuales. Reproducir estas pequeñas estructuras con precisión y consistencia es uno de los desafíos más difíciles de la nanotecnología.
Los investigadores de la Universidad de Osaka han dado ahora un paso importante hacia ese objetivo. escrito en comunicación de la naturalezaEl equipo describe cómo utilizaron un pequeño reactor electroquímico para crear poros que interactúan con dimensiones subnanométricas.
Imitando las puertas de enlace eléctricas de la naturaleza
Dentro de la célula, los iones viajan a través de canales proteicos especializados incrustados en la membrana celular. Este movimiento iónico crea señales eléctricas con impulsos nerviosos responsables de la contracción muscular. Los canales están formados por proteínas y contienen regiones muy estrechas en la escala de angstrom. Cuando se exponen a señales externas, estas proteínas cambian de forma, permitiendo que los canales se abran o cierren.
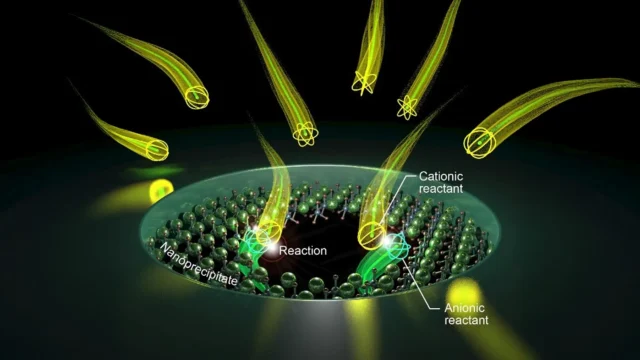
Inspirándose en este sistema natural, los investigadores diseñaron una versión de estado sólido capaz de crear pequeños poros similares a canales iónicos biológicos. Comenzaron creando un nanoporo en una membrana de nitruro de silicio. Ese nanoporo actúa entonces como una pequeña cámara de reacción para crear poros aún más pequeños en su interior.
Cuando el equipo aplicó un voltaje negativo a través de la membrana, desencadenó una reacción química dentro del nanoporo. Esta reacción produjo un precipitado sólido que se expandió gradualmente hasta bloquear completamente la abertura. Al invertir el voltaje, se restablecen las vías de conducción a través de los poros, disolviendo la descarga.
“Pudimos repetir este proceso de apertura y cierre cientos de veces durante varias horas”, explicó el autor principal Makusu Tsutsui. “Esto demuestra que el esquema de retroalimentación es sólido y controlable”.
Los picos eléctricos revelan poros subnanométricos
Para comprender mejor lo que sucedía dentro de la membrana, los investigadores monitorearon la corriente iónica que la atravesaba. Observaron picos agudos en la corriente, similares a los patrones observados en los canales iónicos biológicos. Un análisis más detallado indicó que estas señales eran más consistentes con la formación de numerosos poros subnanométricos dentro del nanoporo original.
El equipo también descubrió que podían ajustar el comportamiento de los agujeros. Al ajustar la composición química y el pH de las soluciones reactivas, cambiaron tanto el tamaño como las propiedades de las aberturas ultrapequeñas.
“Pudimos cambiar el comportamiento y el tamaño efectivo de los microporos cambiando la composición y el pH de las soluciones reactivas”, informa Tomoji Kawai, autor principal. “Esto permitió el transporte selectivo de iones de diferentes tamaños efectivos a través de la membrana ajustando los tamaños de los poros ultrapequeños”.
Aplicaciones en secuenciación de ADN y computación neuromórfica
Este enfoque impulsado químicamente hace posible crear múltiples poros ultrapequeños dentro de un solo nanoporo. La técnica ofrece una nueva forma de estudiar cómo los iones y fluidos se mueven a través de espacios muy confinados en una escala comparable a la de los sistemas vivos.
Más allá de la investigación básica, la tecnología puede respaldar campos emergentes como la detección de una sola molécula (por ejemplo, usando nanoporos en secuencias de ADN), la computación neuromórfica (usando picos eléctricos para imitar el comportamiento de las neuronas biológicas) y los nanoactores (creando escenarios de respuesta únicos a través del confinamiento).